Ressourceneffiziente Katalyse
Neue Organokatalysatoren und kooperative Katalyseverfahren für die stoffliche Nutzung von CO2 als Synthesebaustein
Verschiedene Studien weisen darauf hin, dass der globale Klimawandel eng verknüpft ist mit der Emission anthropogener Treibhausgase. Dabei entfällt der weitaus größte Anteil dieser Emissionen auf das Kohlendioxid (CO2). In der Gesamtstrategie zum CO2-Management nimmt die stoffliche Nutzung von CO2 als Synthesebaustein neben der Vermeidung eine zentrale Rolle ein. Die atomökonomische und wirtschaftliche Verwendung von CO2 als Synthesebaustein ist eng mit der effizienten Aktivierung dieses sehr stabilen Moleküls verknüpft.
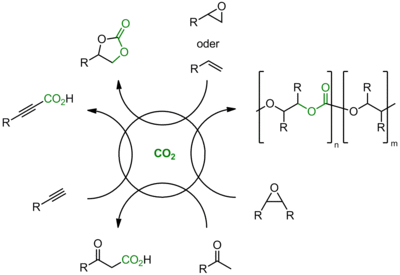
Das Ziel unserer Arbeiten ist die Entwicklung neuer metallfreier Katalysatoren, sogenannter Organokatalysatoren, für die Synthese industriell relevanter Produkte unter stofflicher Verwertung von CO2 als C1‑Baustein. Die Kombination dieser Katalysatoren mit metall- oder enzymkatalysierten Verfahren in (sequenziellen) Eintopfreaktionen soll darüber hinaus zu kooperativen Katalysatorsystemen bzw. Verfahren mit hoher Selektivität und Energieeffizienz führen. Diese alternativen Synthesemethoden unter Einbeziehung von vor- und nachgelagerten Schritten sollen eine Änderung bzw. Erweiterung der Rohstoffbasis unter Verwertung von CO2 ermöglichen. Gegenstand der Untersuchungen sind Transformationen mit hohem CO2-Fixierungspotential, die zu Produkten führen, welche von großem industriellen Interesse sind (Abbildung 1).
Im Folgenden soll ein kurzer Überblick über zwei ausgewählte Teilprojekte gegeben werden:
Bisher synthetisierten wir unter anderem eine Reihe bifunktioneller Phosphoniumsalze und evaluierten deren Potential als Katalysatoren unter verschiedenen Reaktionsbedingungen in der Synthese cyclischer Carbonate aus Epoxiden und Kohlendioxid. Basierend auf dem Katalysatorscreening konnten wir Struktur-Wirkungs-Beziehungen aufstellen und vielversprechende Kandidaten identifizieren. Des Weiteren wurden die Reaktionsparameter anhand eines Modellsystems optimiert. Schon unter vergleichsweise milden Bedingungen (90°C, p(CO2)= 10 bar) konnten nach 2–3 h quantitative Umsätze für 15 verschiedene Epoxide erzielt werden (Schema 1). Die Reaktion wurde in den Multigramm-Maßstab überführt, wobei der Reaktionsverlauf mittels in situ FTIR verfolgt werden konnte.
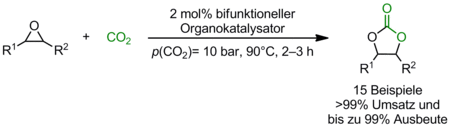
Synthese von Polycarbonaten
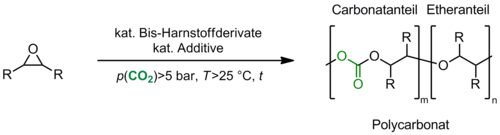
Bis-Harnstoffderivate sind bekannte Oxo-Anionenrezeptoren. Wir synthetisierten eine Reihe dieser Verbindungen und setzen sie als Katalysatoren in der Copolymerisation von CO2 mit Epoxiden ein (Schema 2). Hierbei sollten die postulierten anionischen Zwischenstufen in der Copolymerisation stabilisiert werden, um so ein kontrolliertes Kettenwachstum zu ermöglichen. Darüber hinaus wurden die Harnstoffderivate zum Teil in Kombination mit Metallsalzen eingesetzt. In Abhängigkeit vom Katalysatorsystem und den Reaktionsbedingungen konnten Copolymere mit einem Carbonatanteil >80% und einem Molekulargewicht >35.000 g·mol–1 in exzellenten Ausbeuten erhalten werden.

Dieses Projekt wird durch das Bundesministerium für Bildung und Forschung (BMBF) innerhalb der Fördermaßnahme "Technologien für Nachhaltigkeit und Klimaschutz – Chemische Prozesse und stoffliche Nutzung von CO2" gefördert.
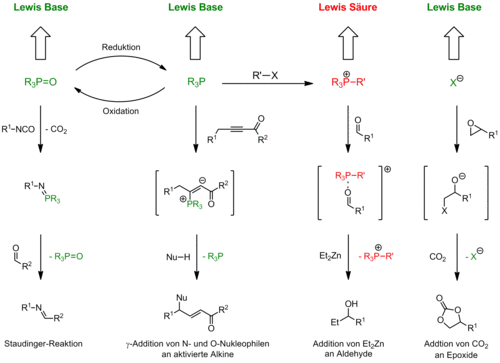
Phosphane sind eine wichtige Klasse von Liganden in Metallkomplexen. Aufgrund ihrer herausragenden Rolle in der homogenen Katalyse ist eine Fülle von Synthesen sowohl achiraler als auch chiraler Phosphane in der Literatur beschrieben. Darüber hinaus sind viele dieser Verbindungen auch kommerziell erhältlich. Phosphane und deren Derivate spielen jedoch nicht nur als Liganden, sondern auch als Reagenzien in der organischen Synthese eine wichtige Rolle. Als Beispiele seien hier die Umsetzung von Alkoholen zu Halogeniden (Appel-Reaktion), die Olefinierungen von Ketonen und Aldehyden (Wittig-Reaktion) und die Synthese von Iminen durch die Staudinger-Reaktion genannt. Im Vergleich zu ihrer immensen Bedeutung als Liganden und Reagenzien spielen Phosphane in der Organokatalyse eine eher untergeordnete Rolle.
Wir untersuchen den Einsatz von Phosphanen und deren Derivaten als Katalysatoren in einer Reihe von Reaktionen unter Nutzung derer Lewis basischer bzw. Lewis saurer Eigenschaften (Abbildung 2). Ziel ist in der Regel die Entwicklung asymmetrischer Varianten der dargestellten Reaktionen durch den Einsatz chiraler Phosphane bzw. deren Derivate. Ein zweites Ziel ist die Entwicklung katalytischer (asymmetrischer) Varianten von Verfahren, in denen Phosphane bisher in stöchiometrischen Mengen eingesetzt wurden. Als Beispiel sei hier die katalytische Wittig-Reaktion genannt.
Im Folgenden soll ein kurzer Überblick über ausgewählte Projekte gegeben werden:
Asymmetrische intramolekulare γ‑Addition an aktivierte Alkine
Als Ausgangsverbindungen für die phosphinkatalysierte intramolekulare γ‑Addition wurden O-, S- und N-funktionalisierte aktivierte Alkine dargestellt und cyclisiert (Schema 3). Hierbei gelang erstmals auch die Umsetzung von N-Derivaten in dieser Reaktion. Ein intensives Screening chiraler Phosphine lieferte bisher Produkte mit bis zu 84% ee.

Addition von Et2Zn an Aldehyde
Neben der Verwendung von Phosphanen als Lewis-basische Katalysatoren sind wir am Einsatz von Phosphoniumsalzen als potentielle Lewis-saure Organokatalysatoren interessiert. In diesem Kontext untersuchen wir die Addition von Diethylzink an Aldehyde als Modellreaktion (Schema 4). Es ist bekannt, dass diese Reaktion durch Lewis Säuren katalysiert werden kann. Wir konnten zeigen, dass Bu4PCl ein effizienter Katalysator für diese Umsetzung ist. Bei der Verwendung chiraler Phosphoniumsalze wurden jedoch nur Racemate erhalten und ein starker Einfluss des Anions auf Umsatz und Ausbeute beobachtet. Weitere Untersuchungen zeigten, dass die Aktivierung durch das Lewis basische Gegenion erfolgt und die Reaktion auch durch eine Kombination aus Alkalisalzen und Kronenethern katalysiert werden kann.
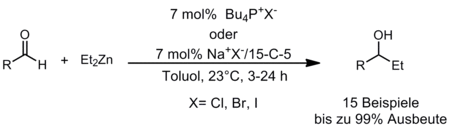
Katalytische Wittig-Reaktion
In unserem Bestreben phosphanvermittelte Reaktionen in katalytische Prozesse zu überführen, untersuchten wir unter anderem die Wittig-Reaktion. Wir entwickelten bisher sowohl eine mikrowellenassistierte katalytische Variante dieser Reaktion, bei der kommerziell erhältliches Tributylphosphanoxid als Präkatalysator zum Einsatz kommt, als auch eine thermische Variante unter Verwendung eines leicht zugänglichen Phospholanoxids als Präkatalysator (Schema 5). Durch die richtige Kombination von Reduktionsmittel, Base und Katalysator gelang uns vor kurzem die Durchführung katalytischer Wittig-Reaktionen für über 20 Substrate. Die dabei erzielten Ausbeuten und Selektivitäten waren zum Teil wesentlich höher als die bisher beschriebenen.

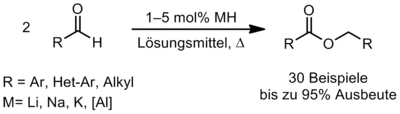
Metallhydridvermittelte Tishchenko-Reaktion
In unseren Untersuchungen zur katalytischen Wittig-Reaktion beobachteten wir bei der Verwendung von Natriumhydrid als Base in unserer Modellreaktion die Dimerisierung von Benzaldehyd zu Benzylbenzoat (Tishchenko-Reaktion). Basierend auf dieser Beobachtung entwickelten wir eine einfache katalytische Methode zur Dimerisierung aromatischer Aldehyde (Schema 6). Diese Reaktion lässt sich bequem aufskalieren und mittels in situ FT-IR Spektroskopie verfolgen. Einen vorgeschlagenen Mechanismus konnten wir durch verschiedene Experimente mit isotopenmarkierten Substraten und Abfangreaktionen untermauern. Hieraus entwickelten wir eine effiziente Methode für die Dimerisierung sowohl aromatischer als auch heteroaromatischer und aliphatischer Aldehyde.