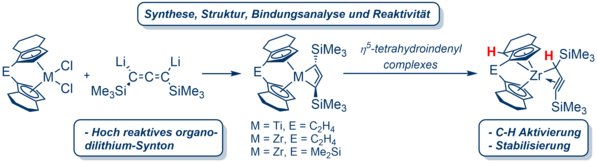Katalyse früher Übergangsmetalle
Dr. Fabian Reiß
Die Gruppe befasst sich mit den Grundlagen von Katalysen früher Übergangsmetallkomplexe, vor allem von Metallen der Gruppe 4, auf der Basis präparativer metallorganischer Chemie und Koordinationschemie. Der Fokus der Untersuchungen liegt dabei auf der Koordinierung und Aktivierung kleiner ungesättigter sowie reaktionsträger Moleküle (z.B. Olefine, Alkine, Isocyanide, Nitrile, Carbodiimide, CO2), die durch Kupplung an Metallkomplexen in stöchiometrischen und katalytischen Reaktionen in teilweise ungewöhnliche metallorganische und organische Strukturen überführt werden können.1
Wir befassen uns mit der Chemie ungewöhnlicher Gruppe 4-Metallacyclen mit dem Ziel, die Grenzen der Koordinationschemie zu erweitern. Durch den Einbau von ungesättigten Einheiten in cyclische Strukturen erhöht sich die Ringspannung, was die Machbarkeit solcher Strukturen einschränkt. Die formale Substitution von z.B. Methylen-Einheiten gegen geeignete Metallfragmente bietet dennoch einen Zugang zu einer Reihe exotischer Verbindungen. So gelang uns nach Testung verschiedener Ansätze und Optimierung der Synthese eines geeigneten Organo-dilithium-Synthons die erstmalige Darstellung eines Titanacyclobuta-2,3-diens, was formal einem metallorganischen Analogon des hoch gespannten und nicht existenten Cyclobuta-1,2-diens entspricht.2 Wir konnten zeigen, dass der eingesetzte ansa-Metallocen-Ligand einen maßgeblichen Beitrag zur Stabilisierung dieses ungewöhnlichen Strukturmotivs leistet. Kürzlich konnten wir dieses Konzept auf Zirconocene übertragen wobei die Zirconacyclobuta-2,3-diene einer zuvor nicht beobachteten C-H Aktivierung am ansa-Liganden unterliegen und zu neuartigen propargyl/allenyl-Komplexen reagieren.3 Gegenwärtig sind ausführliche Studien der Reaktivität dieser neuen Substanzklasse gegenüber kleiner ungesättigter sowie reaktionsträger Moleküle Gegenstand der Forschung.
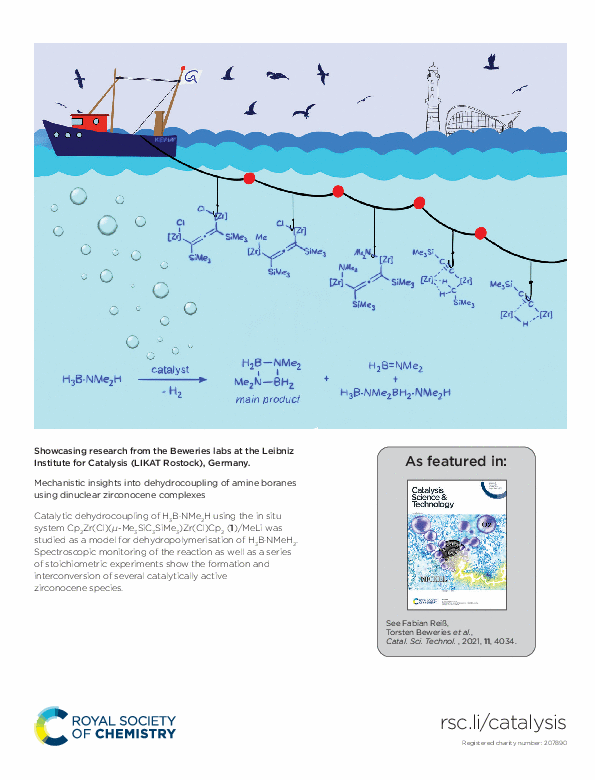
Bei Variation des Metallocens zu Cp2MCl2 (M = Zr, Hf) reagiert das Organo-dilithium-Synthon in Abhängigkeit von der eingesetzten Stöchiometrie entweder zu ungewöhnlichen achtgliedrigen Metalla-cyclooctatetraenen oder zu dinuklearen Allen-verbrückten Metallocen-Chlorido-Komplexen.2b,4 Letztere wurden von uns intensiv im Rahmen eines bereichsübergreifenden Projektes als Katalysatoren für die Dehydrokupplung von Amin-Boran-Addukten untersucht, wobei mithilfe experimenteller Befunde sowie quantenmechanischen Berechnungen die dinukleare Natur des Katalysators als wesentliches Merkmal aufgedeckt wurde.5 Auf Basis umfangreicher Kenntnisse zur Chemie von Gruppe 4-Metallocen-Komplexen werden aktuell in weiteren Untersuchungen neue Katalysatorstrukturen entwickelt und getestet sowie die bestehenden Systeme in weiteren katalytischen Dehydrokupplungen untersucht.
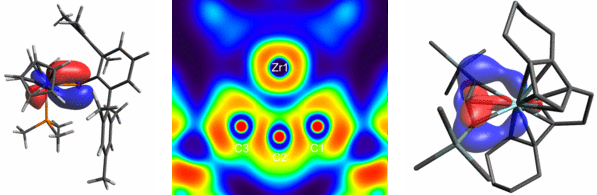
In den vergangenen Jahren konnten wir zusätzlich moderne Methoden der quantenmechanischen Modellierung von Katalysatorsystemen in der Gruppe etablieren. Die systematische Analyse vermuteter Reaktionsmechanismen mit Hilfe von Dichtefunktionaltheorie-Berechnungen untermauert dabei unsere experimentellen Befunde in vortrefflicher Weise und erzeugt eine positive Rückkopplung für die zukünftige Katalysatorentwicklung.5b Eine Reihe von quantenmechanischen Bindungsanalysen wie z.B. NBO, AIM, CAS hilft uns zusätzlich ein tieferes Verständnis der Struktur-Eigenschafts-Beziehungen in aktiven Katalysator-Substrat Komplexen zu erlangen.6 Diese neu etablierten Stärken möchten wir in Zukunft gewinnbringend in neue Projekte einbringen.
In der Gruppe stehen u. a. Standard-Apparaturen zum Arbeiten unter Schutzgas (Hochvakuum-Schlenklinien, vier Gloveboxen), elektrochemisches Equipment, automatische volumetrische Messstände zur Messung von Gasverbräuchen und Gasentwicklungen, die auch unter photochemischen Bedingungen betrieben werden können, Autoklaventechnik, sowie Gaschromatographie, 31P-Benchtop-NMR-Spektroskopie, Massenspektrometrie und UV-Vis-Spektroskopie zur Verfügung.
Studierende mit Interesse an metallorganischer Synthesechemie, Ligandendesign und der Anwendung in der homogenen Katalyse sind herzlich Willkommen die Gruppe im Rahmen von Praktika, Bachelor- und Masterarbeiten oder Promotionsvorhaben zu verstärken.
Bitte senden Sie bei Interesse eine E-Mail an torsten.beweries{at}catalysis.de.
[1] a) F. Reiß, K. Altenburger, D. Hollmann, A. Spannenberg, H. Jiao, P. Arndt, U. Rosenthal, T. Beweries, Chem. Eur. J. 2017, 23, 7891; b) M. Reiß, F. Reiß, A. Spannenberg, P. Arndt, T. Beweries, Organometallics, 2018, 37, 4415; c) P. Arndt, M. Reiß, A. Spannenberg, C. Schünemann, F. Reiß, T. Beweries, Dalton Trans. 2019, 48, 16525.
[2] a) F. Reiß, M. Reiß, A. Spannenberg, H. Jiao, D. Hollmann, P. Arndt, U. Rosenthal, T. Beweries, Chem. Eur. J. 2017, 23, 14158; b) F. Reiß, M. Reiß, A. Spannenberg, H. Jiao, W. Baumann, P. Arndt, U. Rosenthal, T. Beweries, Chem. Eur. J. 2018, 24, 5667; c) F. Reiß, M. Reiß, J. Bresien, A. Spannenberg, H. Jiao, W. Baumann, P. Arndt, T. Beweries, Chem. Sci. 2019, 10, 5319.
[3] X. Shi, S. Li, M. Reiß, A. Spannenberg, T. Holtrichter-Rossmann, F. Reiß, T. Beweries, Chem. Sci. 2021, 12, 16074.
[4] K. Lindenau, E. Zander, C. Schünemann, A. Spannenberg, M. V. Andreev, V. V. Burlakov, F. Reiß, T. Beweries, Organometallics 2021, 40, 3177.
[5] a) M. Trose, M. Reiß, F. Reiß, F. Anke, A. Spannenberg, S. Boye, A. Lederer, P. Arndt, T. Beweries, Dalton Trans. 2018, 47, 12858; b) K. Lindenau, N. Jannsen, M. Rippke, H. Al Hamwi, C. Selle, H. J. Drexler, A. Spannenberg, M. Sawall, K. Neymeyr, D. Heller, F. Reiß, T. Beweries, Catal. Sci. Technol. 2021, 11, 4034.
[6] a) A. Schumann, F. Reiß, H. Jiao, J. Rabeah, J. E. Siewert, I. Krummenacher, H. Braunschweig, C. Hering-Junghans, Chem. Sci. 2019, 10, 7859; b) M. Fischer, F. Reiß, C. Hering-Junghans, Chem. Comm. 2021, 57, 5626; c) F. Reiß, A. Villinger, H. Brand, W. Baumann, D. Hollmann, A. Schulz, Chem. Eur. J. 2022, DOI: 10.1002/chem.202200854.