Neue Hydroformylierungskatalysatoren
Dr. Jens Holz
Die Hydroformylierungsreaktion, d.h. die Synthese von Aldehyden durch Addition von Kohlenmonoxid und Wasserstoff an ein Olefin, zählt zu den wichtigsten großtechnisch angewendeten und homogen durch Übergangsmetalle katalysierten Reaktionen in der aktuellen Zeit. In Abhängigkeit vom Substrat (Olefin) und Katalysator entstehen endständige oder verzweigte Aldehyde. Letztere fallen überwiegend als Racemat bzw. bei entsprechender Steuerung durch den Katalysator auch angereichert zu Gunsten eines Enantiomers an. Der überwiegende Teil dieser gewonnenen Aldehyde fungiert als Ausgangsstoff für die Synthese von Weichmacheralkoholen. Enantiomerenreine iso-Aldehyde sind als Vorstufen für Pharmaka (Antiphlogistica) interessant.1
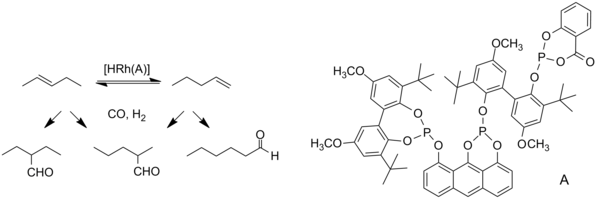
Unsere Arbeiten konzentrieren sich auf die Synthese neuer, patentfreier P(III)-Verbindungen, die Ermittlung deren Potenzials als Liganden in der Rhodium-katalysierten Hydroformylierung2 und Untersuchungen mit anderen katalytisch aktiven Metallen (z.B. Cobalt-Katalyse).3 Mechanistische Untersuchungen, z. B. mittels Druck-NMR-Spektroskopie, sowie die zeitaufgelöste Beobachtung metallorganischer Komponenten mittels in situ FTIR-Spektroskopie und die exakte kinetische Beschreibung des gesamten Reaktionssystems4 mit Hilfe neu entwickelter chemometrischer Tools5 sollen das Verständnis der katalytischen Reaktion erweitern (siehe Folgeseiten). Im Mittelpunkt stehen vor allem Untersuchungen zur isomerisierenden Hydroformylierung. Dieses Reaktionsprinzip erlaubt den kinetisch kontrollierten Zugang zu gewünschten n-Aldehyden aus preiswerten internen Olefinen im Zuge einer Konsekutivreaktion von Olefin-Isomerisierung und selektiver terminaler Hydroformylierung (vgl. Abbildung 1). Mit unseren Rhodiumkatalysatoren (überwiegend mit bidentaten P-Liganden wie Diphosphiten und Diphosphoniten) wurden n-Regioselektivitäten bis 99% und Umsatzfrequenzen bis 6000 molOlefin x molKatalysator-1 x h-1 erreicht.6-8 In den letzten Jahren verschoben sich allerdings die Anforderungen an das zu realisierende Carbonylierungsprodukt. Statt der maximalen Ausbeute an n-Aldehyden liegt der Focus jetzt auf die Erzielung von Endprodukten mit einer definierten Zusammensetzung an n- und iso-Aldehyden. Dies führt in der Ligandensynthese zu neuen Ansätzen und Herausforderungen in puncto der strukturellen und elektronischen Eigenschaften der Verbindungen im Gegensatz zu den zuvor für die maximale n-Selektivität hergestellten P-Verbindungen.
Auf der Grundlage unserer Ergebnisse wurden in Jahren 2019-2021 vom Kooperationspartner Evonik Industries AG ca. 10 Patentanmeldungen getätigt. Für 2022 ist bisher eine Anmeldung in Bearbeitung.
Neben der dominierenden Hydroformylierung als Hauptschwerpunkt in unseren Arbeiten, bleiben auch weiterhin zielgerichtete Arbeiten auf dem Gebiet der Hydrierung (u.a. Rh-, Ru- und Ir-Katalyse) im Portfolio unserer Tätigkeiten. Neben Arbeiten in der Grundlagenforschung, z.B. die Synthese neuartiger (chiraler) Phosphorverbindungen9,10 oder anderer spezieller Probleme11, werden auch spezifische Aufgabenstellungen bei der Durchführung von Hydrierungen im Rahmen von Projekten auf dem Gebiet Pharmazie bzw. Industrie von uns untersucht, um letztendlich entsprechende Lösungen für den Vertragspartner präsentieren zu können.